
喜讯|热烈祝贺!君实生物PD-1单抗“特瑞普利单抗”获FDA批准上市!美国时间2023年10月27日,君实生物与其合作伙伴Coherus BioSciences宣布,PD-1抗体特瑞普利单抗获得FDA批准上市,美国商品名为 LOQTORZI™。 FDA批准特瑞普利单抗适用于联用顺铂/吉西他滨一线治疗晚期复发或转移性鼻咽癌(NPC),特瑞普利单抗不仅是美国FDA批准上市的首个中国自主研发和生产的创新生物药,在美国首个且唯一获批用于鼻咽癌治疗的药物,也是君实生物第二款通过FDA批准在美国实现商业化的产品(第一款是JS016)。这是中国Biotech的一个里程碑事件。
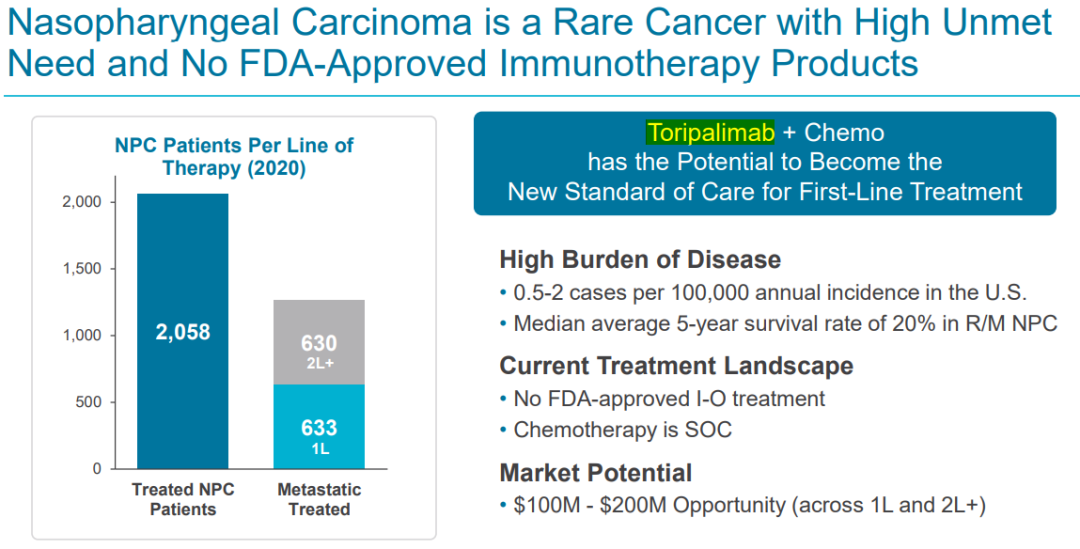
鼻咽癌(NPC)是一种原发于鼻咽部粘膜上皮的恶性肿瘤,是一种罕见肿瘤。据统计,2020年全球鼻咽癌新发病例数超过 13 万人。在美国,每10万人中有0.5-2例患病,R/M NPC中位平均5年生存率为20%,且在此获批前,尚无免疫疗法获批用于治疗鼻咽癌。特瑞普利单抗联合化疗有望成为鼻咽癌一线治疗的新的标准疗法。
特瑞普利单抗(中文商品名:拓益)是一款以PD-1为靶点的单抗药物,也是首个向FDA提交BLA的国产抗PD-1单抗,其BLA申请也曾被FDA授予优先审评。据悉,此次批准主要基于JUPITER-02(一项针对一线治疗鼻咽癌的随机、双盲、安慰剂对照、国际多中心Ⅲ期临床研究)及POLARIS-02(一项针对二线及以上治疗的复发或转移性鼻咽癌的多中心、开放标签、Ⅱ期关键注册临床研究)的研究结果。金墁利医药此次也有幸参与到这两项研究中,并为研究中探讨血浆EBV DNA可作为复发性或转移性鼻咽癌的预后以及疾病动态监测的标志物提供了关键性数据结果。
特瑞普利单抗登陆美国,对于中国医药产业来说也是一件标杆性的事件,在经历了百转千折之后,终于迎来第一个成功登陆美国市场的国产PD-1药物。金墁利也期待未来能有更多的中国创新药出海成功,中国生物医药更自信地走向国际。




